我々は基板上の微小井戸構造を脂質二分子膜でシールし、チャネルタンパク質を再構成することによって、シナプス情報伝達を模倣したナノバイオデバイスの実現を目指している。これまでに我々は、光学的手法によるチャネルタンパク質の機能計測について報告してきた[1]。しかしながら、実際には、基板と脂質膜の間に存在する薄い水層からのイオンリークがあり、単一タンパク分子レベルの微小なチャネル電流を検出するような高感度センシング実現のためには、解決すべき課題となっている。そこで本研究では、微小井戸を囲む金リング構造を新たに設け、その上に自己組織化膜(SAM)を作製することによってイオン拡散のブロック層とし、高ギガオームシーリングの形成、デバイスの低ノイズ化を検討した[2]。
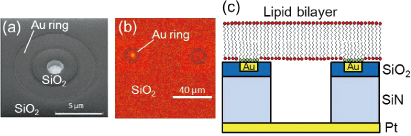
底部に電極を備えた微小井戸(直径2 µm、深さ1 µm)をシリコン基板上に作製した。井戸の周囲に金のリング構造を作製した[図1(a)]。この基板をoctadecanethiol中に浸漬させ、金表面へのSAM形成を行った。この基板上で巨大脂質膜ベシクル(DPhPC : Cholesterol = 4 : 1 + Rhod-DPPE 1mol%)を展開し、微小井戸を脂質膜でシールした。
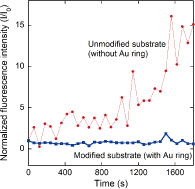
図1(b)は緑色蛍光色素を封入した微小井戸の蛍光像(赤は脂質膜)である。金リング内側をレーザで消光したところ、蛍光回復が観察されたことから、脂質分子の側方拡散は維持されており、図1(c)で示した膜構造が実現されていると考えられる。図2は従来型デバイス(金リングなし)と金リング付きデバイスを用いて、微小井戸内にCa2+インジケータ(fluo-4)を封入し、蛍光強度の経時変化を観測した結果である。従来型デバイスでは、時間経過とともに蛍光強度の増大が見られた。これは、基板と脂質膜の間の水層からCa2+が流入してきたためであると考えられる。一方、金リング付きデバイスでは、蛍光強度の変化はほとんど見られなかった。これは、新たに導入した金リング上のSAM構造によりCa2+の流入が防がれたためであると考えられる。膜抵抗の測定をしたところ、従来型デバイスでは4-10 GΩ、金リング付きデバイスでは20-100 GΩ以上と1桁程度のシール抵抗の向上が見られた。バックグラウンドノイズ(rms)もそれぞれ、2.7 pA、1.3 pAと有意な減少が見られ、金リング付き構造が低ノイズ・高感度なセンシングに有効であることが示された。