オンチップ型酸化グラフェンアプタセンサ:2本鎖DNAスペーサを用いた高感度化
グラフェンおよび酸化グラフェン(GO)の表面では、表面に近接した分子との相互作用に応じたエネルギー移動反応が生じる。この反応を、生体分子の反応と巧みに組み合わせることで、生体分子の選択的な吸着などの現象を可視化可能である。私たちは、グラフェン/GO表面をアプタマという特殊なDNAで機能化した表面(生体分子インターフェース)を用いて、タンパク質を選択的かつ高感度に検出する蛍光検出型のアプタセンサを実現した[1]。さらに、グラフェン/GOを表面に固定化するという特長を活かすことで、マイクロ流路を搭載したオンチップ型アプタセンサへの展開をはかり、複数タンパク質の同時検出や定量検出など、分析化学的に意義高い応用が可能となった[2]。
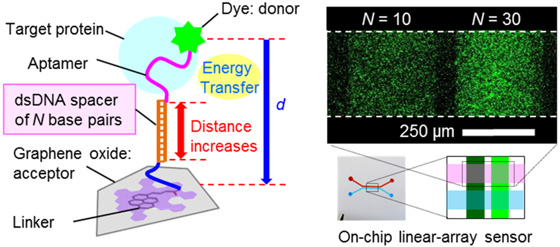
アプタマの最も魅力的な特徴は、その分子認識機能を損なうことなく、自由自在な分子設計による機能化が可能という点である。そこで、グラフェン/GOへの蛍光分子の発光エネルギーの移動(蛍光共鳴エネルギー移動、FRET)の効率が蛍光色素とグラフェンの間の距離に依存して大きく変化することを利用して、アプタセンサの感度を飛躍的に向上させるプローブ分子の戦略的な設計を行った。アプタマ配列と蛍光色素の間に1本鎖DNAをスペーサとして導入した分子プローブ①[3]およびアプタマ配列とグラフェン/GO表面の間に2本鎖DNAをスペーサとして導入した分子プローブ②を設計した[図1(左)][4]。①、②のどちらにおいても、スペーサ長に応じてセンサの高感度化がはかれることを見い出した[図1(右)]。設計した分子プローブのうち、最も高感度化効果が高かったプローブを用いて、in vivo凝固反応中の濃度レベル(1 nM)のトロンビン検出限界を達成した[3]。
- [1] K. Furukawa et al., J. Mater. Chem. B, 1, 1119 (2013).
- [2] Y. Ueno et al., Anal. Chim. Acta, 866, 1 (2015): Featured on cover.
- [3] Y. Ueno et al., Chem. Commun., 49, 10346 (2013): Featured on cover.
- [4] Y. Ueno et al., Anal. Sci., 31, 875 (2015): Hot Article Award.
|
| 図1 (左)分子プローブ②の構成と(右)スペーサ長さによる高感度化効果の定量比較。 |