脂質二分子膜を親水性の固体表面、たとえば酸化シリコン表面に吸着させたものを支持脂質二分子膜(SLB:Supported
Lipid Bilayer)と呼ぶことにします。このデバイスは、SLBの持つ二つの動的な性質を利用しています。そのひとつは自発展開と呼ばれる性質です。脂質分子の微小な固まりを付着させた基板を水溶液中に浸漬すると、固まりを起点に基板上にSLBが自発的に成長する性質です(Raedler
et al.)。自発展開の位置と方向の制御は、基板上にパターンを作ることで可能となります。SLB中に目的の分子を混合しておけば、SLBの自発展開によって分子を基板上の目的の位置に輸送することができます。
もうひとつは分子拡散と呼ばれる性質です。脂質二分子膜は基板に吸着させてもその流動性を保持しています。このことは、退色後の蛍光回復によって示されます。ある時刻で強い励起光を照射して円形の部分の蛍光色素を失活させた後、その部分の蛍光が回復する様子を、アニメーションで見ることができます。これは分子同士が動いている証拠です。回復の時間変化から、分子の動きの拡散定数を求めることができます。その結果、分子の拡散は意外に早いことが分かりました[注1]。
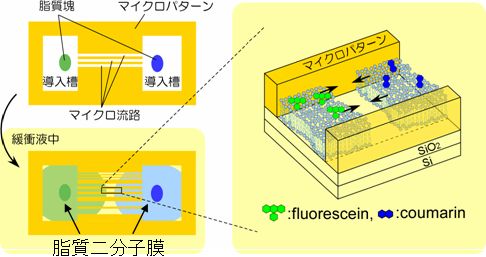
これら二つの動的特性をどのように結びつけたかについて、以下に述べます。図に示すように、基板表面にパターンを作製します。幅10マイクロメートル、長さ数百マイクロメートルの流路の両サイドには、脂質の固まりを固定する槽を設けてあります。脂質の固まりには、目的の分子(この場合は色素が結合した脂質分子です)が組み込まれています。両方の槽から自発展開するSLBは、流路の中間で互いに衝突します。衝突するまでは、自発展開特性が利用されています。流路中で衝突した二つのSLBは互いに他を乗り越えることなく、一体化した一枚のSLBとなり、自発展開はそこでとまります。すると、一体化したSLB内で、今度は分子拡散が起こり、衝突した地点を境に二つの分子の混合が起こります。このとき二つの分子の間に相互作用があれば、それを検出できるかもしれません。
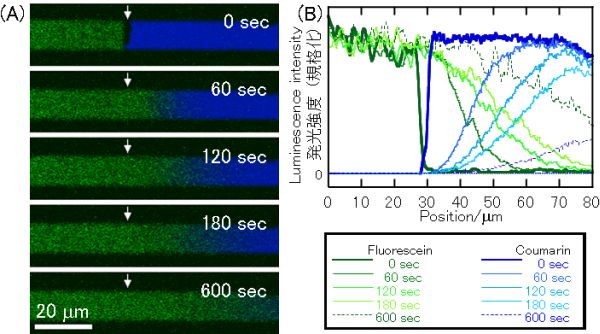
実際に分子間相互作用を検出した例を示します。二つの色素の間には、蛍光共鳴エネルギー移動反応(FRET, Fluorescence Resonance Energy Transfer)が起こることが知られています。このデバイスを用いても、FRETの様子が明瞭に観察されました。衝突後は、矢印で示した衝突地点の左右対称にそれぞれの色素分子が分布し、混合領域を形成します。その様子は緑色蛍光の時間変化を見るとわかります。ところが青色蛍光は、時間がたっても緑色蛍光のように拡散していく様子が観測されません。これは青色蛍光を発する分子が拡散していかないわけではなく、青色蛍光色素を励起してもそのエネルギーが蛍光を発するのに使用されず、緑色蛍光分子へエネルギーを渡してしまうからです。このとき、青色蛍光分子はドナー、緑色蛍光分子はアクセプタと呼ばれます。
このデバイスは、生物の原理である自己組織化を、ナノテクノロジーの産物であるパターン化基板上で行い、得られた微小な“場”を用いて、化学反応や分子間相互作用を観察するデバイスです。このような融合領域での研究を推進することによって、ナノテクノロジーとバイオテクノロジーとを結びつけて新しい研究領域を切り開こうとしています。
[注1]具体的には1秒あたり1マイクロメートル四方に拡散する。マイクロメートル(μm)は1メートルの100万分の1。