薬理学的刺激による単一イオンチャネル受容体の構造変化
我々はこれまで『ナノバイオデバイス』の創製を目指した研究を進めている。ナノバイオデバイスは、生体機能の検出・制御を可能とする微小デバイスであり、新規な科学的知見・治療方法・創薬の創出につながる新しい素子である。本報告では、マイカ基板上に支持された脂質膜中に再構成したイオンチャネル受容体について薬理学的刺激による構造変化を高速原子間力顕微鏡(高速AFM)により検討した[1]。高速AFMはナノメートルスケールの空間分解能、80 ms/frameの時間分解能を有するプローブ顕微鏡で、タンパク質の構造変化の観察に理想的な方法である。
本研究はN-methyl-D-aspartate型のリガンド作動性のイオンチャネル型グルタミン酸受容体(GluNR)について検討を行った。これはラットの大脳皮質の神経細胞から精製した受容体で、あらかじめ架橋脂質膜に再構成し電気生理計測法を用いてチャネル活性を確認したものである。
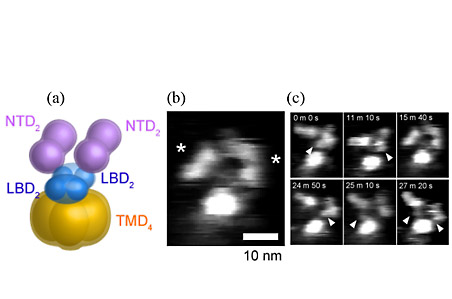
近年の構造に関する研究からGluNRはリガンド結合部位(LBD)とN末端ドメイン(NTD)が2回対称であり、dimer-of-dimersと呼ばれる2つの二量体からなる構造を有していると言われている(図1(a))。脂質膜に再構成していない単一のGluNRの観察結果から、2つのサドル型の粒子(NTD)と1つの球状粒子(膜貫通ドメイン、TMD)を確認することができた(図1(b))。さらに数十分間にわたる構造観察により、GluNRのNTDはフレキシブルな構造をもつことがわかった(図1(c))。
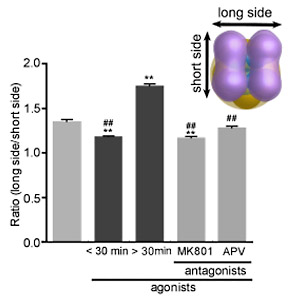
次に、支持膜中に再構成したGluNRの細胞外ドメインについてリガンドによる構造変化を定量的に検討した。リガンドがない状況で四量体構造を有するNTDは、複数の構造、たとえば、サブユニットが分離していない構造、2回あるいは4回対称・dimer-of-dimersなど複数の構造を示した。アゴニスト処理を行うと、NTDの柔軟性が小さくなりdimer-of-dimers構造を示すものが多くなり、アゴニスト処理時間を30分以上にすると、NTDダイマ間の距離が長くなった。そのダイマ間距離の増加はアンタゴニストによる前処理で抑制されることがわかった(図2)。
これらの結果は、GluNRは細胞外の部位がフレキシブル・ダイナミックであること、またシリコン基板上の支持脂質膜に再構成した後も、外因性の薬物刺激により構造が制御されていることを、受容体が活性を有する状態で、単一受容体を対象として初めて観察したものである。
[1] Y. Shinozaki, A. Tanaka, and N. Kasai, et al., Appl. Phys. Express 7 (2014) 027001.
 |
 |
|
|