中島寛 古川一暁
機能物質科学研究部
生体分子を利用した素子開発において、生体分子の機能や構造を保持したまま、基板上で分子を安定に担持できる“バイオインタフェース”の構築は重要な技術要素である。また、基板上で生体分子の位置・密度・配向が制御できれば、超高感度バイオセンサやインプラント型バイオチップなど、多様な生体機能素子へむけた設計指針を示すことができる。今回、バイオインタフェースを担う材料として、細胞を構成する細胞膜に着目した。シリコンやガラスなどの固体基板上に、人工的に作製した細胞膜(人工細胞膜)を堆積させ、膜上の特定の位置に生体分子を固定化する、あるいは望みの位置に生体分子を輸送する、新たな生体分子マニピュレーション技術を見出した[1]。
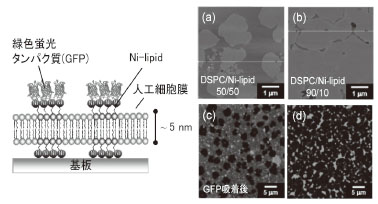
細胞膜は、主にリン脂質分子(lipid)から構成される。人工細胞膜では、用いるlipid種によって、膜の流動性を制御することができる。本研究では、室温で高/低流動性を有する人工細胞膜を作り分け、さらに特定のアミノ酸(ヒスチジン基)を末端に持つタンパク質を特異吸着する“ニッケル錯体含有リン脂質分子(Ni-lipid)”を膜中に混合し、人工細胞膜をデザインした。図1(a),
(b)に、DSPC(低流動性lipid)とNi-lipidからなる人工細胞膜のAFM像を示す。両lipidを50 %ずつ含む膜では、DSPCが局所的に集合したドメイン構造を形成し、Ni-lipidはドメイン以外の領域に均一に分布する。各lipid領域の高さの差は、わずか1
nmである。また膜中のドメインパターンは、各lipidの混合比によって大きく変化する。この膜上に、末端ヒスチジン基を有する緑色蛍光タンパク質(GFP)を吸着させると、Ni-lipidの領域のみに選択的にGFPが固定化することが蛍光顕微鏡像から明らかとなった[図1(c),
(d)]。一方、DOPC(高流動性lipid)とNi-lipidからなる人工細胞膜は、均一な膜構造を形成し、高い流動性を有する。この膜は、溶液中で厚さ5
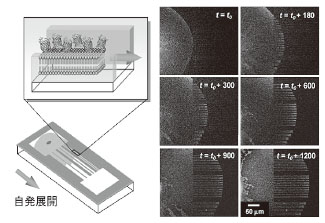
nmの単分子膜を自発的に成長させる性質があり[2]、これを利用したタンパク質の分子輸送をはじめて実証した。図2は、マイクロ流路内を輸送されるGFPの時間発展観察像である。この輸送特性は、既知の人工細胞膜拡散モデル[速度(ν) = (β/時間(t ))1/2]と良く一致し、その展開速度係数(β)は10.4 µm2/sであった。
人工細胞膜からなるバイオインタフェースは、生体分子間の情報伝達を解析する細胞膜モデル場として利用することも可能である。生体素子開発へむけた基盤材料開発とともに、基礎科学の側面からも、バイオインタフェースのポテンシャルを追求していく。
[1] H. Nakashima et al., Langmuir 26 (2010) 12716.
[2] K. Furukawa et al., Lab Chip 6 (2006) 1001.
 |
 |
|||||
|
|